肿瘤新药研发现状与挑战——徐兵河教授解读中国抗肿瘤基础研究与转化
来源:陆士新医学基金会2025-09-15 21:15:26

2025年9月14日,由北京陆士新医学基金会主办,国家卫生健康委员会百姓健康频道(CHTV)和医学论坛网共同承办的中国国际服务贸易交易会“肿瘤治疗创新进展与药物研发新趋势论坛”在北京首钢园区举行。会上,中国工程院院士、中国医学科学院肿瘤医院教授徐兵河分享题为《中国抗肿瘤新药研发的现状与挑战》的专题报告,介绍了全球和中国癌症现况,系统梳理我国抗肿瘤新药研发的跨越式发展成果,深刻剖析当前面临的核心挑战,并为我国肿瘤防治事业高质量发展注入新思考。

全球肿瘤防控:
严峻数据下的“用药刚需”
徐兵河教授在报告中首先指出,肿瘤作为严重危害人类健康的重大疾病,其防治工作在全球范围内依然面临严峻挑战。他援引最新数据称,2022年全球癌症新发病例约2000万例,死亡病例约970万例;而我国作为肿瘤负担最为沉重的国家之一,同年新发癌症病例达482万例,死亡病例257万例。
抗肿瘤药物的研发与可及性,已成为影响整体防治效果的关键因素。值得注意的是,肿瘤创新药研发目前已占全球新药研发管线的近三分之一,这一比例仍在逐年提升。徐兵河特别强调,在2015至2024年间,肿瘤学领域临床试验数量占全球所有临床试验的41%,较十年前增长58%,显示出该领域持续的研发活力。
在这一全球创新浪潮中,中国正扮演越来越重要的角色。我国自主研发的抗肿瘤新药数量持续增长,临床试验数量显著增加,逐步成为全球抗肿瘤药物研发的重要力量。然而,徐兵河也指出,在研发模式创新和源头突破方面,我们仍面临诸多挑战,需要从跟随创新向引领创新转变。
中国创新跨越:
从“仿造跟随”到“全球第二”
在回顾我国抗肿瘤新药研发历程时,徐兵河教授强调,我国已成功实现从“仿制”到“创新”的艰难跨越。从2011年首个自主创新小分子靶向抗癌新药埃克替尼上市,到2014年首个完全自主研发抗癌新药甲磺酸阿帕替尼获批,再到近年来阿基仑赛、优替德隆、吡咯替尼、甲苯磺酸多纳非尼等12款创新肿瘤药物密集获批,我国自主创新抗肿瘤药物研发成果显著。数据显示,我国国产创新药历年IND(临床试验申请)受理号数量较2010年增长超28倍,截至2024年8月,中国新药批准上市数量已位居全球第二,仅次于美国,在研药物管线数量同样跻身全球前列,展现出强劲的创新活力。

徐兵河教授讲解肿瘤学试验现状
值得关注的是,我国下一代抗肿瘤药物研发呈现爆发式增长态势。徐兵河教授介绍,截至2024年1月1日,中国药企在研的创新产品数量较2021年7月增加
了近一倍,First-in-class(FIC,首创新药)产品(从418个增至836个,增长率100%)。其中,ADC(抗体药物偶联物)研发尤为活跃,2024年全球ADC相关肿瘤临床试验达228项,成为实体瘤领域增长最快的治疗方式之一。细胞疗法、基因疗法、双抗/多抗、ADC、PROTAC和核酸药物等下一代产品增长迅速。在靶点研发方面,我国在研药物靶点数量从2021年的375个增至2024年的670个,涵盖220个肿瘤学靶点,CD19、HER2、BCMA、CLDN18.2、PD-1等热门靶点研发成果显著,多靶点组合数量也实现翻倍增长,创新广度与深度持续拓展。
国际化进阶:
从“中国造”到“全球用”
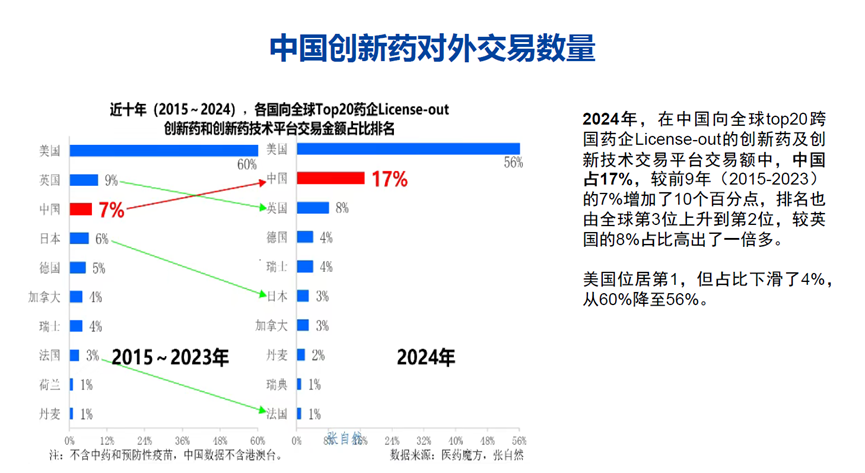
在国际化布局方面,徐兵河教授指出,我国创新药正加速融入全球研发体系。2021年7月至2024年6月,我国已有8款原研创新药物成功进入海外市场,其中7款通过授权国际合作伙伴实现“出海”;2024年我国向全球Top20跨国药企License-out(对外授权)的创新药及创新技术平台交易额占比达17%,较2015-2023年的7%提升10个百分点,排名跃居全球第二。标志性成果包括百济神州泽布替尼在美国获批并实现年销售额超10亿美元(美国市场占比80%)、传奇生物CAR-T疗法西达基奥仑赛获美国FDA及欧洲、日本监管机构批准,康方生物依沃西单抗在全球PD-1+VEGF双抗赛道研发中位居前列,彰显我国创新药的国际竞争力。
挑战与破局:
从“同质化”到“真原研”
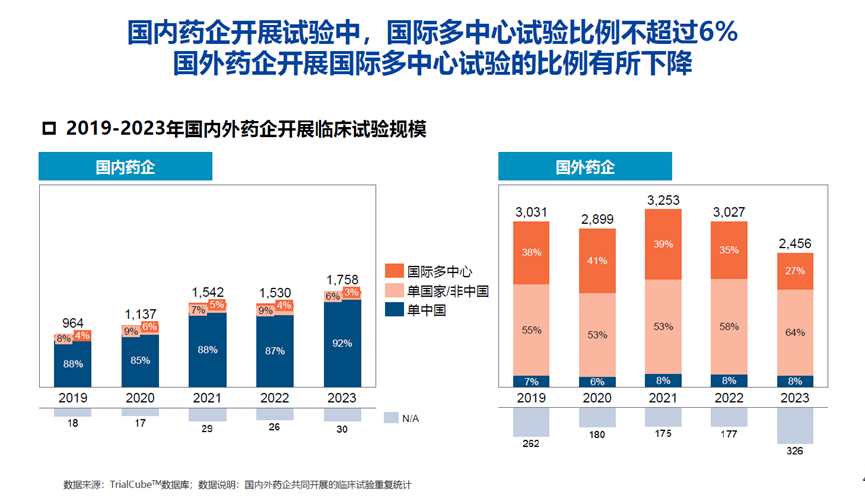
尽管成果丰硕,徐兵河教授也指出,我国抗肿瘤新药研发面临的多重挑战。其一,靶点开发同质化问题严重,我国在研单抗药物前十靶点占比达47%,远超全球22%的水平,CD47、Claudin 18.2、Trop2等新兴靶点已呈现“扎堆”研发趋势,创新差异化不足;其二,源头创新储备薄弱,基础研究能力与国际领先国家存在差距,生物医学领域顶级期刊论文占比、高被引学者数量等关键指标仍显不足,从基础研究到临床转化的链条尚未完全打通;其三,临床研究能力有待提升,国内药企开展的国际多中心临床试验(MRCT)比例不足6%,Ⅲ期临床试验占比明显低于国外药企,临床试验设计创新性与数据质量仍需优化;其四,出海难度持续加大,美国FDA对中国临床数据审查趋严,2023年仅2款中国创新药获FDA批准,国际化进程面临更高标准考验。
针对这些挑战,徐兵河教授提出明确的突破路径。他强调,推动真正意义上的首创新药研发,必须强化基础研究与转化医学投入,建立“从临床到实验室再到临床”的双向转化体系,聚焦未被满足的临床需求,挖掘具有中国特色的疾病机制与靶点;要充分发挥人工智能技术的赋能作用,例如通过AI进行蛋白质结构预测、潜在靶点发现、药物分子设计优化,以及整合临床、病理与诊断等多模态数据,打破信息孤岛,从而加速研发进程、提升靶点选择精准性与临床试验效率。
此外,徐兵河指出,还需深化生物技术与信息技术(BT-IT)的融合,构建数据驱动的新药研发新范式。同时,要加强多学科交叉与协同创新,推动化学、材料学、纳米技术等领域与药物研发的深度融合,通过政产学研用紧密合作,培养复合型人才,完善创新药研发生态体系。

徐兵河教授表示,我国抗肿瘤新药研发已站在从“并跑”向“领跑”跨越的关键节点。未来要以患者需求为核心,以临床价值为导向,持续攻坚基础研究瓶颈,加快创新技术转化,推动更多中国原研新药走向世界,为全球癌症防治贡献中国智慧与中国方案,助力《健康中国2030规划纲要》中“总体癌症5年生存率提高15%”的目标早日实现。
当前,中国抗肿瘤新药已经走过“有没有”的阶段,下一步要解决“好不好”“首创不首创”。徐兵河教授总结,只有让基础研究、监管科学与产业资本同频共振,才能把14亿人的临床需求转化为全球认可的中国方案,让更多癌症患者用得上、用得起、用得好国产创新药。

 CHTV 百姓健康微信
CHTV 百姓健康微信